(CNN) — El verano pasado, después de más de una década de enfermedad, Lawrence Faucette y su esposa, Ann, enfrentaron la dura realidad de que el final de su vida estaba cerca.
Tenía 58 años y padecía insuficiencia cardíaca terminal. La enfermedad de las arterias periféricas lo hizo no elegible para un trasplante de corazón.
Después de una semana particularmente agotadora en el hospital, donde los médicos no lograron que su corazón funcionara como debía, decidió que ya había tenido suficiente. Decidió irse, pensando que preferiría morir en casa.
Pero antes de que pudiera irse, vino un último médico a hablar con él. Durante dos horas, repasó lo que estaba viendo y, por primera vez –dijo Ann–, dando respuestas realmente directas sobre su condición.
Durante esa larga conversación, el médico hizo una pregunta inusual: ¿Considerarían algún día el xenotrasplante?
publicidad
“Al principio, no teníamos idea de lo que querían decir, pero estábamos interesados en cualquier cosa”, dijo Ann.
Ann y Larry sabían un poco sobre la ciencia. Se habían conocido tres décadas antes mientras asistían a la escuela de laboratorio médico cuando ambos estaban en el Ejército. Entendieron que el xenotrasplante significaba trasplantar tejido de un animal a una especie diferente. Sabían que los médicos han utilizado durante mucho tiempo válvulas de cerdo para reparar el corazón humano.
Pero lo que se ofrecía ahora era diferente: se podía trasplantar a Larry un corazón sano procedente de un cerdo que había sido modificado genéticamente para que sus órganos se adaptaran mejor a los humanos.
Al buscar en su teléfono durante el viaje de regreso a su casa en Frederick, Maryland, Larry descubrió que este tipo de trasplante se había probado solo en otra persona viva. No había garantías de que funcionara para él y los médicos no sabían cuánto duraría.
La necesidad de más órganos para trasplantes es inmensa y creciente. Algunos científicos piensan que los órganos animales podrían ser una buena manera de aumentar el suministro, pero la ciencia se ha estancado mientras los investigadores intentan descubrir cómo prevenir el rechazo de órganos y evitar infecciones peligrosas. También tienen que desenmarañar complicadas cuestiones éticas, incluido cómo probar dichos órganos.
Pero los avances recientes en clonación y edición de genes, junto con una mejor comprensión del control de infecciones, han llevado a un puñado de instituciones a lograr avances: pasos clave que podrían permitir a la Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés), un día cercano, aprobar un ensayo clínico.
Los investigadores han trasplantado riñones y corazones de cerdo genéticamente modificados a personas con muerte cerebral para probar si funcionan en humanos. Este mes, los médicos demostraron que el hígado de un cerdo podía filtrar la sangre cuando se lo adhería a una persona recientemente fallecida. La semana pasada, los médicos dijeron que habían identificado la combinación de inmunosupresores necesarios para evitar que los cuerpos humanos rechacen los riñones de cerdo.
Y en dos ocasiones, los cirujanos han trasplantado corazones genéticamente modificados a personas vivas: sujetos de prueba voluntariosos que comprendieron que su muerte era inminente y que ningún trasplante probablemente los salvaría, pero que los xenotrasplantes podrían salvar muchas vidas en el futuro.
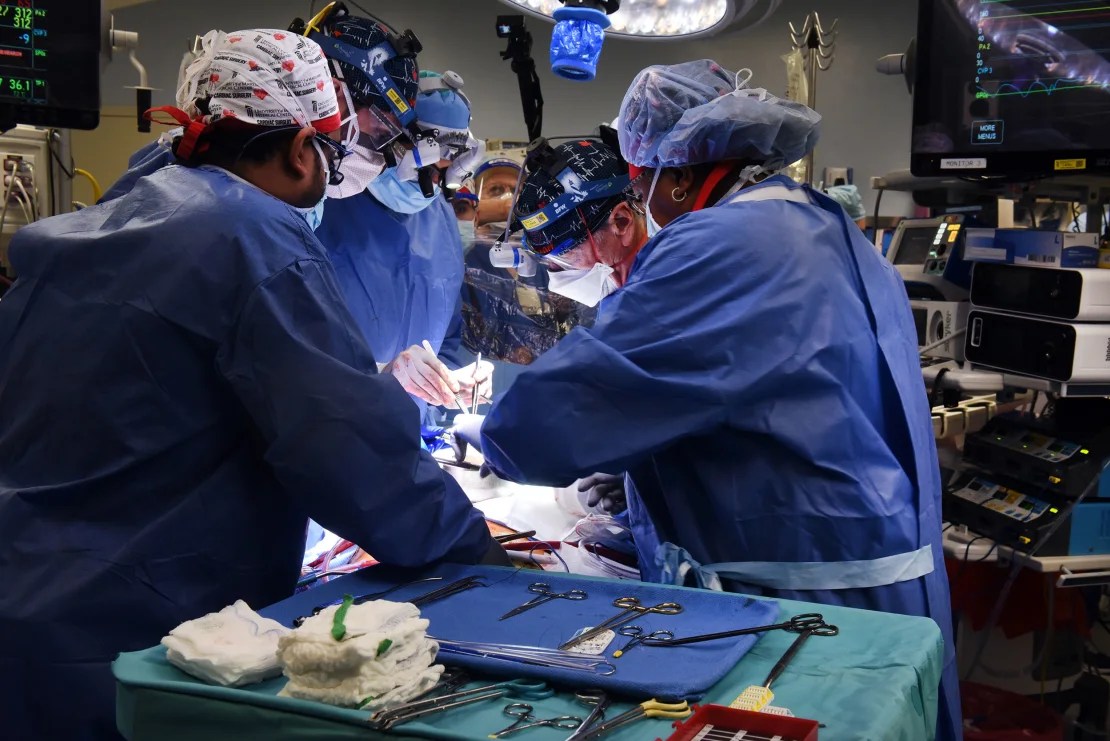
Aunque Larry Faucette estaba demasiado enfermo para un trasplante de corazón humano, los médicos de la Universidad de Maryland dijeron que parecía lo suficientemente fuerte físicamente para un corazón de cerdo genéticamente modificado. Lo enviaron a una serie de expertos: los cirujanos que explicaron con más detalle el procedimiento, un especialista en Ética Médica, trabajadores sociales y un psicólogo.
Después de que la FDA aprobara el procedimiento a través de su programa de “uso compasivo” en septiembre, recibió un corazón de cerdo modificado para funcionar en un ser humano.
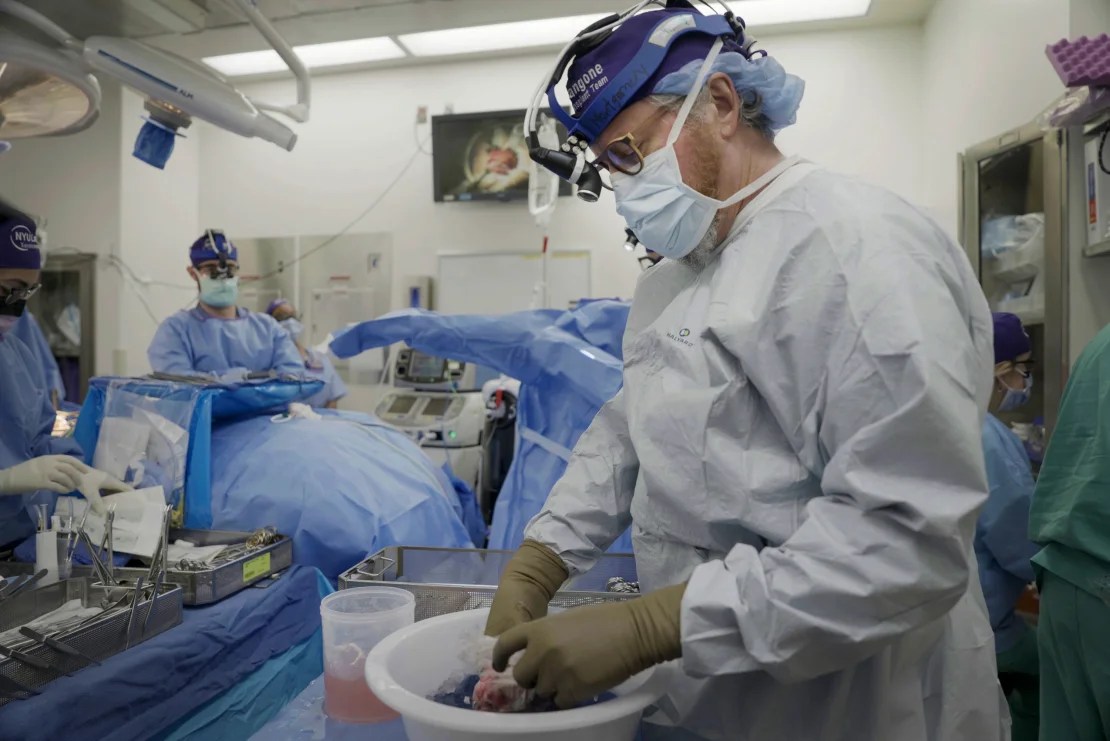
Los xenotrasplantes son algo muy cercano al Dr. Robert Montgomery, director del Instituto de Trasplantes Langone de la Universidad de Nueva York. (Shelby Lum/AP)
Larry, científico contratado en el Instituto Nacional de Alergias y Enfermedades Infecciosas durante casi 10 años, fue realista acerca de sus posibilidades con el corazón. Pero estaba convencido de que si podía ayudar a los médicos a aprender y eventualmente beneficiar a otros, estaría bien con ser “un conejillo de indias humano”, dijo Ann.
Aun así, Ann tenía la esperanza de que funcionara, aunque fuera por un tiempo.
“Un paradigma roto”
En Estados Unidos, más de 100.000 personas esperan un trasplante de órgano. No hay suficientes donantes, e incluso si todos se inscribieran para hacerlo, menos del 1 % de los que se ofrecen como voluntarios mueren de tal manera que sus órganos sean viables para el trasplante. En un día normal mueren 17 personas esperando un órgano.
“Que alguien tenga que morir para que alguien viva es un paradigma roto”, afirmó el Dr. Robert Montgomery, director del Instituto de Trasplantes Langone de la Universidad de Nueva York y uno de los investigadores que ha estado explorando los xenotrasplantes. “Creo que los animales son la respuesta”.
Para Montgomery, la ciencia es personal. En 1976, cuando tenía 14 años, perdió a su padre a causa de un fallo cardíaco. Pasó más de una década desde el primer trasplante de corazón, pero mucho antes de que tales procedimientos se volvieran relativamente rutinarios.
En ese momento, los médicos dijeron que no valía la pena el trasplante. Aunque hoy en día la mayoría de los pacientes sobreviven y pueden vivir muchos años con trasplantes de corazón, en la década de 1970, menos de la mitad de los que recibieron un trasplante de corazón vivían más de un año.
“Eso ha estado en mi cerebro durante todos estos años”, dijo Montgomery.
Tiene el mismo problema genético que causó la insuficiencia cardíaca de su padre. Hace cinco años, se sometió a su propio trasplante de corazón. Pero el número de órganos donados es tan limitado que sufrió siete paros cardíacos antes de siquiera calificar para estar en la lista de donantes.
“Hay que volar guiado por el sol, ya sabes, sin terminar quemándote, que es lo que termina haciendo la mayoría de la gente”, dijo Montgomery. Los xenotrasplantes, afirmó, “realmente van a cambiarlo todo”.
Trasplantar órganos de animales a humanos no es una idea nueva. Hace décadas, los médicos pensaban que los primates eran los mejores candidatos para el xenotrasplante y, en 1984, trasplantaron un corazón de babuino a un niño que vivió 21 días.
“Pero los primates resultaron ser demasiado pequeños, demasiado caros y demasiado controvertidos”, afirmó el Dr. Art Caplan, profesor de Bioética y director fundador de la División de Ética Médica del Departamento de Salud de la Población, de la Facultad de Medicina Grossman de la Universidad de Nueva York. Los primates tampoco se reprodujeron tan rápido como los cerdos.
En pocas palabras, Caplan dijo: “No funcionó”.
Los órganos de los cerdos, sin embargo, son anatómicamente similares a los de los humanos. Durante más de tres décadas, las válvulas cardíacas de cerdo se han utilizado para reparar corazones humanos. Los productos porcinos se incluyen en docenas de medicamentos que salvan vidas, como la epinefrina, que se usa para tratar reacciones alérgicas graves, y la heparina, un anticoagulante.
Los humanos también se sienten más cómodos éticamente con los órganos de los cerdos que los primates no humanos, dijo Caplan. Los cerdos han aparecido en historias “al estilo Disney” que hacen que la gente se compadezca, pero “Babe” y “Charlotte’s Web” no impidieron que todos comieran carne de cerdo “a un ritmo de aproximadamente 1.000 millones por año”, dijo Caplan. “Por eso es un poco difícil oponerse al uso de una docena en trasplantes”.
Aun así, trasplantar un órgano completo de un cerdo ha sido difícil debido a diferencias genéticas que hacen que el cuerpo humano los rechace. También existe la preocupación de que un órgano de cerdo pueda contener un virus latente que podría dañar a un receptor humano e incluso propagarse a otros humanos.
Un camino hacia la esperanza
En una granja de investigación del Medio Oeste, cerdos que gruñen y resoplan y se mueven hacia el frente de sus corrales con la esperanza de recibir un malvavisco. Están siendo criados por eGenesis, una de las empresas de biotecnología que desarrolla animales para xenotrasplantes, para investigaciones que incluyen estudios con primates.
“Estos donantes tienen el potencial de salvar la vida de personas”, dijo el CEO y presidente de eGenesis, Dr. Mike Curtis, al corresponsal médico jefe de CNN, Dr. Sanjay Gupta, mientras observaba a los animales a su cuidado. “Estamos así de cerca”.

Para la familia de Jim Parsons, saber que él ayudó a hacer avanzar la ciencia ofrece cierto consuelo.
(Parsons Family/University of Alabama at Birmingham)
Para crear los cerdos, eGenesis comienza con una muestra de piel aislada de una raza llamada minicerdo de Yucatán y la cultiva para expandir las células, luego usa CRISPR para realizar 69 ediciones que insertan algunos genes humanos y eliminan algunos genes porcinos. Otras empresas, incluidas las que han suministrado los órganos para los experimentos más recientes con humanos, utilizan menos ediciones.
Para convertir las células editadas en un cerdo, se requiere clonación, tomando las células editadas y fusionándolas con un óvulo de una donante al que se le ha extraído el núcleo para crear un embrión de cerdo. Luego, ese embrión se transfiere a una cerda sustituta. Los lechones genéticamente modificados nacen por cesárea y son criados por el personal de eGenesis.
Durante todo el proceso, los cerdos se mantienen en condiciones extremadamente limpias. Cuando los humanos interactúan con ellos, aunque sea para darles un malvavisco, deben ducharse y usar zapatos y ropa proporcionados por la empresa. En una etapa temprana de su vida, los cerdos son especialmente propensos a las infecciones, y la infección podría representar un riesgo importante para los receptores humanos.
“Para habilitar toda esta tecnología, necesitamos tener el equivalente a cinco o seis descubrimientos del Premio Nobel”, dijo Curtis. “Estamos integrando a todos ellos para que esto sea una realidad”.
La realidad es que los xenotrasplantes todavía tienen que dar pasos importantes antes de que estén disponibles para el público en general.
No se ha estudiado en ensayos clínicos. La FDA dijo a CNN que los xenotrasplantes son “muy prometedores, pero también conllevan riesgos potenciales” y que recomienda que dichos trasplantes se limiten a personas con enfermedades graves o potencialmente mortales para quienes no hay alternativas adecuadas disponibles.
Para esos pacientes y sus familias, es un camino estrecho hacia la esperanza.
Los primeros intentos
En septiembre de 2021, Julie O’Hara estaba ayudando a sus hijos a planificar el funeral de su padre cuando recibió una llamada urgente de un cirujano. No tenía sentido en ese momento: Jim Parsons, de 57 años, tenía muerte cerebral después de un accidente de moto y no había ninguna posibilidad de sobrevivir.
La Dra. Jayme Locke, directora del Instituto Integral de Trasplantes de la Universidad de Alabama en Birmingham, básicamente dijo que no podía traer de vuelta al exmarido de O’Hara, pero sí convertirlo en una parte importante de la historia médica. Locke estaba pidiendo trasplantar dos riñones de cerdo genéticamente modificados a Parsons, no porque los necesitara o porque pudieran salvarlo, sino porque podría darles a los médicos la oportunidad de ver si los órganos del cerdo funcionaban de manera segura en un cuerpo humano.
A principios de ese mes, un equipo de la Universidad de Nueva York (que incluía a Caplan y Montgomery) había planeado y realizado un procedimiento similar, trasplantando un riñón de cerdo genéticamente modificado a una persona con muerte cerebral. Durante 54 horas, el riñón produjo orina y pareció funcionar como lo haría un trasplante de riñón humano, y no hubo signos de rechazo.
O’Hara dijo que a Parsons le hubiera gustado ser parte de la investigación. “Sabemos que la donación de órganos fue definitivamente el camino a seguir para nosotros”, dijo.
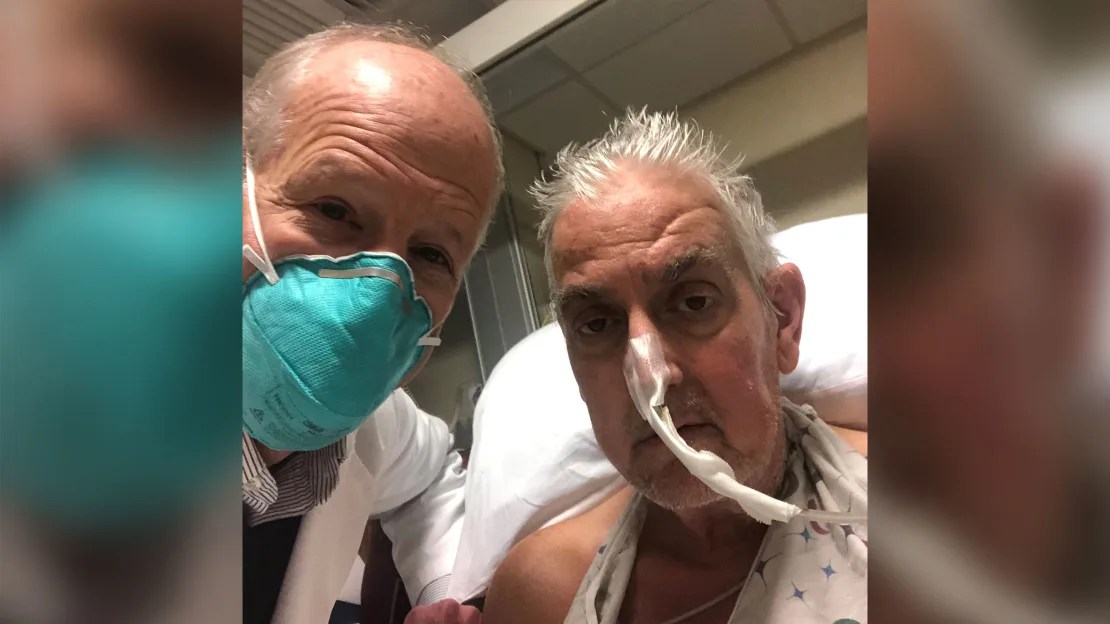
El Dr. Bartley Griffith y David Bennett, en enero de 2022. (University of Maryland School of Medicine)
Con el permiso de O’Hara, actuaron rápidamente para trasplantar los dos riñones de cerdo.
“En cierto modo, fue surrealista”, dijo Locke. “Casi se puede sentir que la habitación contiene la respiración y luego exhala cuando se quitan las pinzas y el riñón se vuelve rosado y comienza a producir orina.
“La magnitud de lo que estamos haciendo, de cómo estamos tratando de ayudar a la gente, es emocionante, abrumadora, humilde y alegre”.
Al año siguiente, en enero de 2022, los cirujanos de la Facultad de Medicina de la Universidad de Maryland dieron otro salto y trasplantaron un corazón de cerdo modificado genéticamente a una persona viva.
David Bennett Sr., de 57 años, sufría de insuficiencia cardíaca terminal y había estado postrado en cama durante semanas, conectado a una máquina para que su corazón y sus pulmones funcionaran. No reunía los requisitos para un trasplante de corazón humano.
La opción del trasplante de corazón de cerdo era como uno de esos “pases bomba” de los partidos de fútbol que le encantaban a su padre, dijo el hijo de Bennett, David Jr.
Durante semanas funcionó bien. Se hizo más fuerte e inicialmente su cuerpo no mostró signos de rechazar el corazón. Pudo visitar a su familia, hizo fisioterapia e incluso estaba lo suficientemente fuerte como para quedarse despierto y ver el Super Bowl. El video lo muestra cantando débilmente “America the Beautiful” con su fisioterapeuta.
Bennett esperaba volver a casa y ver a su amado perro, Lucky, pero unos 40 días después de la cirugía, dijo su hijo, el corazón del donante comenzó a fallar. Posteriormente, los médicos determinaron que había varios problemas superpuestos. Uno era un virus del cerdo que no se había propagado a otras partes de su cuerpo, pero había causado daños en el corazón.
El cerdo donante había sido examinado varias veces para detectar patógenos utilizando protocolos aceptados por la FDA, y el corazón había sido modificado genéticamente para eliminar el riesgo de infección y rechazo. Bennett también había recibido medicamentos contra el rechazo y el personal del hospital utilizó procedimientos especiales de aislamiento para el paciente y el equipo. Desde entonces, han introducido protocolos de prueba mejorados.
Aun así, el 8 de marzo, unos dos meses después del procedimiento, Bennett murió.
“Fue muy difícil, pero al menos pudimos pasar más tiempo y fue bastante extraordinario ser parte de ese momento histórico”, dijo su hijo.
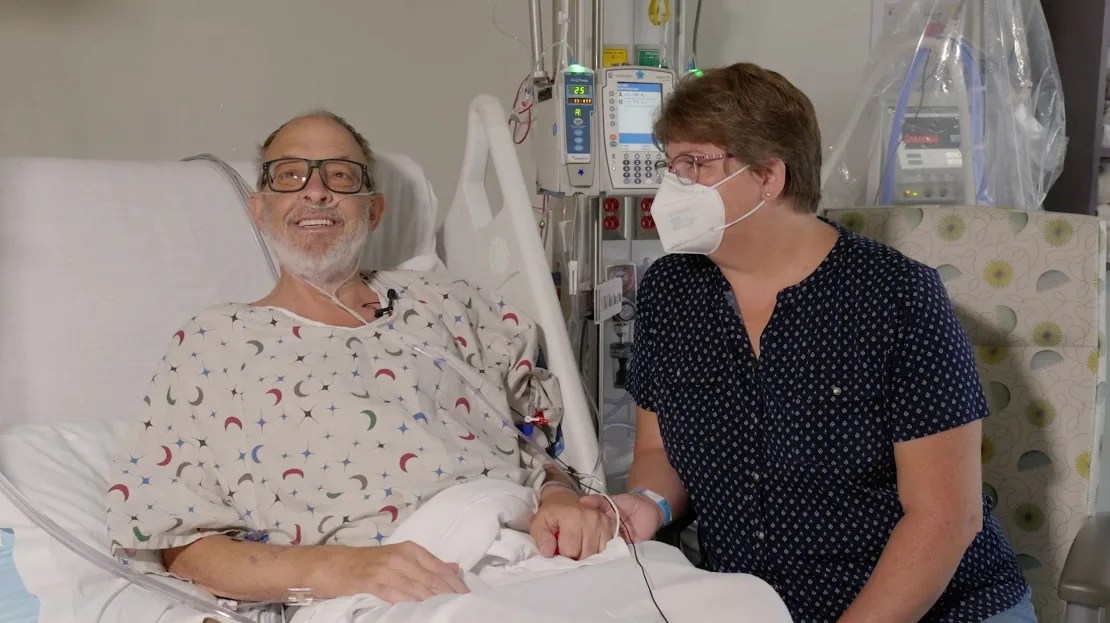
Ann Faucette dice que el humor la ayudó a ella y a su esposo Larry a superar los altibajos que siguieron a su trasplante. (University of Maryland School of Medicine)
Los médicos dicen que los trasplantes en receptores vivos les han enseñado mucho más de lo que podrían aprender de un modelo animal.
“En cada trasplante que hemos realizado, desde el primero, hemos aprendido mucho”, afirmó el Dr. Muhammad M. Mohiuddin, profesor de Cirugía y director científico del Programa de Xenotrasplantes Cardíacos de la Facultad de Medicina, de la Universidad de Maryland.
Aunque entendían cómo funcionaban estos trasplantes en animales, los médicos ni siquiera entendían algunos de los conceptos básicos que necesitarían saber para acercar la ciencia a los ensayos clínicos.
“Aprendimos que el corazón de cerdo es un sustituto adecuado del corazón humano. No podríamos decir eso hasta que realmente pusiéramos un corazón de cerdo y, como una cortadora de césped de gasolina, lo encendiéramos y luego lo dejáramos funcionar”, dijo el Dr. Bartley Griffith, parte del equipo de trasplante de Larry Faucette y David Bennett y profesor de Cirugía Cardíaca en el Centro Médico de la Universidad de Maryland.
“De hecho, al primer corazón lo llamé ‘estrella de rock’ porque seguía girando y apretando maravillosamente”, añadió Griffith. “Antes del rechazo, superaba a un típico trasplante humano”.
El futuro de los xenotrasplantes
Ann Faucette dijo que ella y su esposo no se arrepentían de haber realizado el trasplante de corazón de cerdo, pero que fue difícil ver al amor de su vida pasar por los altibajos después del procedimiento.
Lo que les ayudó a superarlo, en parte, fue el humor. Tan pronto como Larry pudo hablar después de la cirugía, una de las primeras cosas que pidió fue una camiseta que decía “Solo llámame Wilbur”, el nombre del cerdo protagonista de La telaraña de Charlotte, la querida novela de E.B. White. Cuando los médicos tuvieron que limpiar el líquido que rodeaba su corazón, pidió que le dibujaran un cerdo en el vendaje.
En los días buenos, Larry visitaba a su familia. Jugaban al Uno casi todos los días y, finalmente, pudo levantarse de la cama y pedalear en una bicicleta reclinada. La mayoría de los días malos eran cuando necesitaba más cirugías. Su corazón no latía lo suficientemente rápido, por lo que los médicos le añadieron un marcapasos. Uno de los cables del dispositivo hizo un pequeño agujero, por lo que tuvieron que repararlo.
“Todos los avances que logró inicialmente, realmente los perdió al regresar al quirófano varias veces”, dijo Ann.
La Dra. Jayme Locke, centro, dice que la investigación sobre xenotrasplantes ha sido “emocionante, abrumadora y humilde”. (Steve Wood/UAB)
A finales de octubre, el corazón simplemente no parecía estar funcionando tan bien. Los médicos actualizaban a Larry sobre su salud todos los días, pero él se daba cuenta de que la cantidad de sangre que bombeaba el corazón estaba disminuyendo. “Podía sentirlo”, dijo Ann.
A Larry lo colocaron en una máquina de circulación extracorpórea llamada ECMO para darle al corazón la oportunidad de descansar. Pero finalmente, dijo Ann, le dijo a su familia y a sus médicos que pensaba que había terminado. A petición suya, los médicos retiraron la máquina ECMO.
En su último día, contó Ann, pasó tiempo bromeando y recordando.
“Pudo decir esas cosas que no puedes decirle a la gente porque siempre piensas que tienes más tiempo”, dijo Ann.
Murió el 30 de octubre, unas seis semanas después de la cirugía.
“Sabía que iba a suceder y luego obtuvo tiempo extra, y tuve la satisfacción de que él lo aceptó y estuvo de acuerdo”, dijo Ann. “Bueno, tan bien como puedas estar con el final de tu vida”.
En última instancia, Caplan, especialista en Ética de la Universidad de Nueva York, y algunos otros científicos ven los xenotrasplantes como un puente: una solución a relativamente corto plazo que ayudará a poner fin a la escasez de órganos en los próximos cinco a siete años, hasta que los científicos puedan descubrir cómo regenerar los órganos lesionados o no funcionales de una persona.
Algunos investigadores están avanzando con la bioimpresión de órganos en 3D, por ejemplo. Los trasplantes de cerdos pueden llegar a funcionar bien, dijo Caplan, pero “no son tan elegantes”.
No todo el mundo ve los órganos animales como una solución temporal. Mohiuddin, el cirujano de Maryland, dice que si bien todavía hay mucho que aprender, los xenotrasplantes serán una “opción válida”.
“En el futuro, se podrán ofrecer a los pacientes de forma regular y, con suerte, salvarán miles o millones de vidas”, afirmó.
Montgomery, de la Universidad de Nueva York, dijo que los órganos animales algún día podrían reemplazar la diálisis y la necesidad de dispositivos cardíacos. En una década, espera que sean “tan comunes como recibir un órgano de un humano, tal vez incluso más comunes”.
Para Locke, de la Universidad de Alabama en Birmingham, poder llevar los xenotrasplantes desde el laboratorio hasta la cabecera del enfermo tiene que ver con la equidad en salud.
“Eso es lo que me motiva más que cualquier otra cosa: poder ofrecer esta terapia que salva vidas a todos los que vienen a verme”, dijo Locke.
Ante la escasez de órganos, los médicos a menudo tienen que tomar decisiones difíciles sobre quién puede estar en la lista de espera. Con una alternativa viable, esto no sería un problema.
“Algunos días, parece como si estuviéramos reorganizando las camas para tomar el sol en el Titanic porque no tenemos suficientes, por lo que resolver eso es realmente importante para mí”, dijo.
Quienes lo proponen, como Curtis, de eGenesis, dicen que utilizar cerdos como donantes no solo aumentaría el suministro de órganos, sino que también podría reducir el costo de los trasplantes.
Actualmente, los corazones y los pulmones deben trasplantarse dentro de las seis horas posteriores a su extracción. Los riñones tienen un margen de maniobra ligeramente mayor, con una ventana de trasplante de 36 horas. Pero con los órganos humanos, los médicos nunca saben exactamente cuándo estará disponible un órgano, y saber qué órganos están en proceso cambiaría la forma en que opera el sistema y lo haría mucho más eficiente.
“Si sabemos que tenemos un suministro ilimitado de donantes, podemos programar la cirugía”, dijo Curtis. “Eso elimina muchos de los costos de emergencia del sistema”.
Las familias cuyas vidas se han visto afectadas por los xenotrasplantes dicen que ser parte de la solución alivia parte del dolor.
Para los hijos de Parsons, la pérdida de su padre ha sido tan dura como cualquiera podría imaginar, dijo O’Hara. Pero ayudó que donaran su cuerpo a la ciencia y fueran parte de un estudio revisado por pares del que investigadores de todo el mundo pueden aprender. La Universidad de Alabama en Birmingham también denominó modelo Parsons al método para comprobar los órganos de una persona con muerte cerebral, un homenaje que conmovió a la familia.
“No voy a decir que de ninguna manera compensó su muerte, pero hizo que fuera mucho más fácil conocer el legado que dejó”, dijo O’Hara.
En 2023, cuando la familia de Bennett se enteró de que un segundo paciente vivo, Larry Faucette, había recibido un corazón de cerdo, enviaron cartas y dibujos de sus nietos para mostrar su apoyo.
“Es un mundo que no sabes que existe hasta que estás en él, por lo que estás tratando de brindar apoyo como familia y reconocer todo lo que la familia está pasando en ese viaje”, dijo el hijo de Bennett.
La pérdida de Bennett y Faucette también afectó a los médicos que trabajaron con ellos. Griffith, el cirujano de Maryland, dijo que es muy triste perder a un paciente, pero con Faucette estuvo “realmente muy mal por un tiempo”.
“Estos pacientes han sido maravillosos en términos de su capacidad para separar su propia muerte de lo que su participación en ella podría significar para los demás”, dijo Griffith. “Creo que nos sentimos liberados del peso de sentir que tal vez había una sensación de que habíamos experimentado de manera inapropiada”.
Para Ann Faucette, la muerte de su esposo la golpea en momentos inesperados: lloró después de ver una jugada en los playoffs de la NFL que lo habría hecho gritar. Durante la semana, ella cede a las demandas de los perros de Larry y se sienta entre Kate y Lucy para ver “Let’s Make a Deal”, tal como lo habría hecho él.
“Él sabía que cuando falleció lo iban a incinerar y lo sentarían en mi repisa de la chimenea”, dijo Ann. Ahora, la urna que contiene sus cenizas se encuentra junto a dos fotografías del cerdo que prolongó la vida de su marido, dándoles casi dos preciosos meses más juntos.
“Para mí esto fue egoísta. Fue algo más de tiempo”, dijo Ann. “Pero para él, fue la idea de que podía hacer algo para ayudar realmente a los demás”.
Ella quiere seguir hablando de xenotrasplantes, ya que él no puede. Quiere ver más investigaciones. Quiere que el sacrificio de Larry y el suyo propio signifiquen algo.
“Era una montaña rusa”, dijo. “Pero si tuviéramos que hacerlo todo de nuevo, seguiría siendo lo mismo. Aun así lo haríamos”.
Nadia Kounang, de CNN, contribuyó a este informe.